新薬承認スピードアップ がんや希少疾患に特例制度
日本の医薬品で新薬が登場するスピードがさらに早まろうとしている。2017年10月に厚生労働省が新薬の臨床試験を一部省略するなどして、今までより数年早く発売できるようになる特例制度をつくった。がんなどの重大な疾患や患者数が少ない疾患の薬が対象となる。日本国内での新薬開発を企業が優先しやすくなり、恩恵を受ける患者も増えそうだ。
医薬品の開発には長い年月と多額の開発費がかかる。特にヒトに投与して効果や安全性を確かめる臨床試験が大きな要因で、負担の大きさから企業が開発を中止してしまう薬剤もある。
その負担を減らし新薬開発を促そうとする制度が、昨年10月に政府が創設した「条件付き早期承認制度」。厚労省の担当者は「製薬業界からの要望を形にした」と話す。
臨床試験を省略
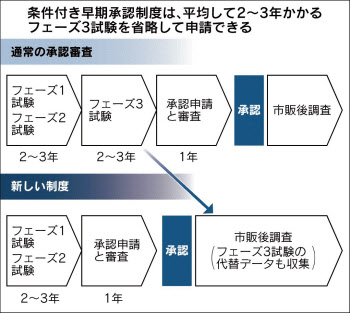
新制度の最大の特徴は臨床試験を従来より大幅に省略できる点だ。通常、医薬品の臨床試験は初期(フェーズ1)、中期(フェーズ2)、後期(フェーズ3)の3段階で進む。このうちフェーズ3が最も大変だ。他の段階より多くの患者を集めて有効性と安全性を確認しなければならない。
このフェーズ3試験をせずに申請できるようになる。代わりに有効性や安全性のデータを市販後に収集するなどの条件を企業に課すため「条件付き」の文言が加わった。
日本製薬工業協会によるとフェーズ3試験にかかる期間は約2年、費用は約40億円にのぼる。省略によるコスト削減効果は大きい。審査期間も通常は12カ月のところが9カ月に短縮される。
もちろん全ての薬剤が対象となるわけではない。重篤な疾患であり、患者数がそもそも少ないなどの理由でフェーズ3試験を行うだけの患者を集めるのが難しく、試験期間の長期化が予想されるような新薬に限られる。対象になるか否かは個別のケースによるという。
それでも業界は新しい制度を好意的に受け止める。英アストラゼネカ日本法人の谷口忠明・専務取締役は「ぜひ普及してほしい。特に一部のがんや小児科領域などは患者も集まりにくいが、新制度を活用できれば開発しやすくなる」と話す。

既に制度を活用する動きもある。エーザイは開発中の新規抗がん剤「MORAb-202」のフェーズ1試験を日本で始めた。同社は「新制度を使って迅速な承認を目指したい」と意気込む。
患者側からも歓迎の声が聞こえる。日本難病・疾病団体協議会代表理事の森幸子さん(58)は「薬の安全性も大事だが、確認のため承認が遅れるのはもどかしい部分があった。多少のリスクがあっても早く使いたいという患者は多い」と話す。
整理し対象拡大
似たような制度は以前からあった。例えば93年にできた希少疾病用医薬品(オーファンドラッグ)指定制度。患者数5万人未満の病気や国の指定難病などの薬が対象で、指定された薬の中にはフェーズ3試験を省略して承認されたものもある。だが条件が明文化されていなかった。それを今回、整理して対象を広げて制度の活用を促した。

近年は医薬品の高額化が著しく、医療費抑制は世界的な流れだ。費用のかかる臨床試験をビッグデータやデバイスを活用して簡略化できないかなど、コスト低減策の検討が世界中で進む。今回の早期承認制度もその流れに沿ったものといえる。
日本では4月に薬価を大幅に引き下げ、「新薬を生む原資が十分に確保できなくなっている」などと業界の反発を招いた。新薬開発の停滞を招かないためにも、様々な手を打つ必要がありそうだ。
◇ ◇ ◇
審査スピード、日本トップ 規制当局の役割大きく
日本は医薬品の審査に時間がかかり、新薬の登場が欧米より数年遅れる――。つい最近まで、製薬業界や医療現場ではこんな認識が一般的だった。いわゆる「ドラッグ・ラグ」の問題だ。
しかし最近では新しい制度の導入などでラグが大幅に解消され、日本が最初に承認するケースも出てきている。審査のスピードが早くなったことが主な要因だ。
日本製薬工業協会の調べによると、日本は審査スピードで2014年から3年連続でトップを維持している。承認が早ければその分、投資回収も早くから可能になり、特許期間も長くなる。製薬企業にとって魅力的に映る。
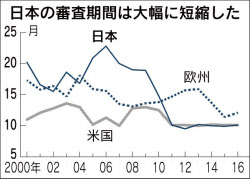
審査は最速レベルとなった日本だが、課題は残る。申請自体が欧米より後回しにされ、結果的に日本市場での新薬の登場が遅れるケースがまだまだ多い。だからこそ申請までの期間を短縮する条件付き早期承認制度は大きな意味を持つ。
もっとも、安全性の確保も重要だ。医薬品の産業振興と、医療の質向上に向けて規制当局の果たす役割はますます大きくなる。
(野村和博)
[日本経済新聞朝刊2018年4月30日付]
健康や暮らしに役立つノウハウなどをまとめています。
※ NIKKEI STYLE は2023年にリニューアルしました。これまでに公開したコンテンツのほとんどは日経電子版などで引き続きご覧いただけます。
関連企業・業界